Лекция 13.
Организация материи на физическом и химическом уровнях
1.
Уровни
химического знания.
2.
Химический
элемент. Атом, его строение, квантовые числа.
3.
Атомное ядро: открытие атомного ядра, измерение его размеров,
массы и заряда, энергия связи нуклонов ядер атомов (дефект массы)
4.
Изотопы.
Естественная радиоактивность: процесс на физическом уровне организации материи
5.
Молекула
как квантово-химическая система
6.
Катализаторы,
биокатализаторы
7.
Полимеры,
мономеры
1. Уровни химического знания
На определенном этапе эволюции
Вселенной ее температура падает, и возникают условия, в которых возможно
формирование атомов вещества. Определенный набор атомов способен образовать новую
систему — молекулу. Организация материи
на атомно-молекулярном уровне приводит к появлению новых свойств материи — к
возможности существования множества
веществ с огромным разнообразием свойств.
Наукой, исследующей закономерности,
проявляющиеся на атомно-молекулярном уровне организации материи, является химия. Задача химии состоит в изучении
строения молекул и процессов изменения этого строения в результате их
взаимодействия.
Фундаментальные
основы химии:
· квантовая механика,
· атомная физика,
· термодинамика,
· статистическая
физика,
· физическая кинетика.
На основе физики построена
теоретическая химия. Из этого не следует, что химия не существует как самостоятельная
наука: химия «выводится» из физики, но
не сводится к ней.
Последовательность, в которой
исторически развивалось химическое знание:
2.
учение
о составе;
3.
структурная
химия
4.
учение
о закономерностях химических процессов;
5.
эволюционная
химия.
Эти учения входят в
иерархическую систему современной химии.
Исследование организации материи на
химическом уровне позволяет выявить взаимосвязь структурных уровней:
Дейсвительно, на химическом
уровне мы имеем дело с очень большим числом частиц, участвующих в квантово-механических
процессах обмена электронами (химических
реакциях). Это обусловливает макроскопичность проявления
законов квантовой физики в химических процессах. Базовое понятие химии — валентность.
|
Валентность - это
макроскопическое, химическое отображение квантово-механических
взаимодействий. |
2. Химический элемент. Атом, его
строение, квантовые числа
Д.И. Менделеев доказал, что признаком
элемента является не экспериментально устанавливаемая неразложимость данного
вещества (как считалось ранее), а место в периодической системе, определяемое
атомной массой.
Позднее, в связи с успехами квантовой
теории, физика помогла составить представление об атоме элемента как о сложной
квантово-механической системе. Место элемента в периодической системе получило
новый смысл, оказавшись обусловленным зарядом ядра атома (Z).
|
Химический
элемент — это вид атомов с одинаковым зарядом ядра, то есть совокупность
изотопов. |
Под это определение попадают как
отдельные атомы, так и находящиеся в химической связи с другими атомами.
Именно заряд атомного ядра определяет
индивидуальность химического элемента.
Свойства химического элемента
определяются электронным строением его атома.
3. Атомное ядро
Открытие атомного ядра. Открытия в области химии и физики в
конце XIX века свидетельствовали о сложном строении атома. В
Стало ясно, что
электроны являются составной частью атомов всех элементов. Но, так как электроны
заряжены отрицательно, а атом нейтрален, очевидно, что внутри атома находится
положительно заряженная часть, которая своим зарядом компенсирует отрицательный
заряд электронов.
Первое представление
об истинных размерах ядра давали опыты Резерфорда и его учеников в
В
Таким образом, под ядром атома понимается его
центральная часть, в которой сосредоточена практически вся масса атома и весь
его положительный заряд. Ядро состоит из нуклонов – протонов и нейтронов
(обозначение p и n). Масса протона mP = 1,673×10-27 =1,836me , mn = 1,675×10-27 = 1835,5me. Масса ядра не равна сумме масс протонов и нейтронов,
входящих в него (т.н. «дефект масс»).
Протон несет
элементарный положительный заряд, нейтрон – частица незараженная. Число
электронов в атоме равно порядковому номеру Z элемента в таблице Менделеева, а число
протонов, поскольку в целом атом нейтрален, равно числу электронов.
Число нейтронов в
ядре определяется следующим образом: NP = A – Z, где А – массовое число, т.е. целое
число, ближайшее к атомной массе элемента в таблице Менделеева, Z
– зарядовое число (число нейтронов). Для обозначения ядер применяется запись
ZXA, где Х – символ химического элемента в
таблице Менделеева. Ядра с одинаковыми Z,
но разными А называются изотопами.
Сейчас известно более 300 устойчивых и более 1000 неустойчивых изотопов. С неустойчивыми
изотопами связано явление радиоактивности – ядерного распада.
Ядро в целом – устойчивая система, для
его разрушения необходимо затратить энергию. Эта энергия называется энергией
связи ядра. Энергия связи, приходящаяся на один нуклон, называется удельной
энергией связи. Нуклоны в ядре удерживаются ядерными
силами, представляющими сильное взаимодействие и имеют обменный
характер. Частица-переносчик взаимодействия – глюон.
4. Изотопы. Естественная
радиоактивность: процесс на физическом уровне организации материи
В настоящее время известно …. С существованием неустойчивых изотопов
(радионуклидов) связано явление естественной радиоактивности.
Радиоактивность –
превращение атомных ядер в другие ядра, сопровождающееся испусканием различных
частиц и электромагнитного излучения. Отсюда и название явления: на латыни radio – излучаю, activus – действенный. Это слово ввела Мария Кюри. При распаде нестабильного
ядра – радионуклида из него вылетают с большой скоростью одна или несколько частиц
высокой энергии. Поток этих частиц называют радиоактивным излучением или попросту
радиацией.
Закон радиоактивного распада как статистический закон. Предсказать,
какой из атомов распадется в данный момент, тогда как другой (ничем от него не
отличающийся) еще сохранится неизменным более или менее длительный промежуток
времени, мы не можем. В этом смысле современные представления фактически
не отличаются от тех, которые были сформулированы в начале века при открытии
радиоактивности. Связано эта с тем, что поведение каждого ядра не зависит от
остальных присутствующих ядер. В принципе все радиоактивные ядра неустойчивы,
поэтому когда-нибудь каждое ядро распадется. Но предугадать поведение данного
ядра в данный момент невозможно: оно может распадаться, а может и уцелеть.
Следовательно, можно говорить лишь о вероятности того, распадется ли данное
ядро за данный промежуток времени. Чем больше ядер или чем больше промежуток
времени, тем больше вероятность того, что хотя бы одно ядро распадется (рис.
1).
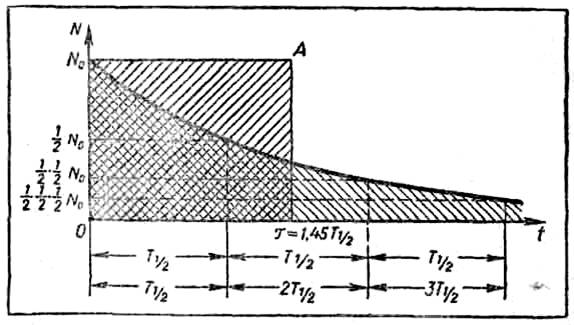
Рис. 1. Кривая радиоактивного распада
Вероятностные события
можно описывать математически лишь при колоссально большом числе возможных
событий (в данном случае количества способных к распаду ядер). Это основной
закон математической статистики — закон больших чисел. При его использовании мы
не можем предвидеть поведение отдельного ядра, но можем с большой точностью
предвидеть поведение очень большого числа ядер. Вероятность того, что в данный
промежуток времени одна из частиц распадется, тем больше, чем больше число
частиц. Количество ядер DNt, которое распадается
за бесконечно малый промежуток времени Dt, должно быть
пропорционально общему числу частиц Nо
(рис. 1), существующих к моменту времени t:
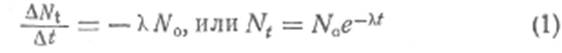
Это и есть основной закон радиоактивного распада.
В этом уравнении
коэффициент пропорциональности называется константой радиоактивного распада, физический смысл которой заключается в
том, что она равна скорости распада при N0 = 1, или, другими
словами, постоянная радиоактивного распада l представляет собой долю распавшихся за
единицу времени ядер от общего числа ядер радиоактивных элементов, имеющихся в
данный момент.
Отношение DN/Dt численно выражает
скорость реакции в данный момент времени t. Так как с течением
времени ядра распадаются и их остается все меньше и меньше, то с уменьшением no скорость распада также уменьшается, на это и
указывает знак минус в уравнении (1). Очевидно, максимальной скорость распада
будет в самом начале, когда t=0 и
число не распавшихся ядер максимально равно no,с течением времени
скорость будет убывать по закону, называемому экспоненциальным. Величина,
обратная константе радиоактивного распада, t=1/l
называется средней продолжительностью жизни
ядра данного изотопа. Если бы скорость радиоактивного распада не
уменьшалась, а оставалась постоянной и равной максимальной (при t = 0 и N = NQ), то все ядра распались бы за время t;
в этом и заключается физический смысл средней продолжительности жизни.
Следует подчеркнуть
статистический характер основного закона радиоактивного распада. Если из уравнения (1) следует, что за данный промежуток времени
должно распасться 100 ядер, то на самом деле их может быть 95 или 105, менее
вероятно — 90 или 110; еще менее вероятно — 80 или 120 и т. д., хотя может
встретиться любая из величин, причем,
чем она больше отличается от 100, тем меньше вероятность ее появления.
Если 100 — среднее (среднестатистическое) число распавшихся ядер, то отклонения
от него называются флуктуациями скорости распада.
Скорость ядерного
распада характеризуется еще одной величиной — периодом полураспада. Величину ограничивают таким интервалом
времени, за которое распадается половина от первоначально взятого количества. Такой
интервал времени называется периодом полураспада T1/2. .
Состав излучения при радиоактивности. Виды
радиоактивных излучений. Когда в руках исследователей появились мощные источники
радиации, в миллионы раз более сильные, чем уран (препараты радия, полония,
актиния), можно было более подробно ознакомиться со свойствами радиоактивного
излучения. В первых исследованиях на эту тему самое активное участие приняли
Эрнест Резерфорд супруги Мария и Пьер Кюри, А.Беккерель, многие другие. Прежде
всего, была изучена проникающая способность лучей, а также действие на
излучение магнитного поля. Оказалось, что излучение неоднородно, а представляет
собой смесь «лучей». Пьер Кюри обнаружил, что при действии магнитного поля на
излучение радия одни лучи отклоняются, а другие нет. Было известно, что
магнитное поле отклоняет только заряженные летящие частицы, причем
положительные и отрицательные в разные стороны. По направлению отклонения
убедились в том, что отклоняемые b-лучи заряжены отрицательно. Дальнейшие опыты
показали, что между катодными и b-лучами нет принципиальной разницы, откуда
следовало, что они представляют собой поток электронов.
Отклоняющиеся лучи
обладали более сильной способностью проникать через различные материалы, тогда
как неотклоняющиеся легко поглощались даже тонкой
алюминиевой фольгой – так вело себя, например, излучение нового элемента
полония – его излучение не проникало даже сквозь картонные стенки коробки, в
которой хранился препарат.
При использовании
более сильных магнитов оказалось, что a-лучи тоже отклоняются, только
значительно слабее, чем b-лучи, причем в другую сторону. Отсюда следовало, что
они заряжены положительно и имеют значительно бóльшую
массу (как потом выяснили, масса a-частиц в 7740 раз больше массы электрона).
Впервые это явление обнаружили в 1899 А.Беккерель и Ф.Гизель. В дальнейшем
выяснилось, что a-частицы представляют собой ядра атомов гелия. Когда же в 1900
французский физик Поль Вийар (1860–1934) исследовал
более подробно отклонение a- и b-лучей, он обнаружил
в излучении радия и третий вид лучей, не отклоняющихся в самых сильных
магнитных полях, это открытие вскоре подтвердил и Беккерель. Этот вид
излучения, по аналогии с альфа- и бета-лучами, был
назван гамма-лучами, обозначение разных излучений первыми буквами греческого
алфавита предложил Резерфорд. Гамма-лучи оказались сходными с лучами Рентгена,
т.е. они представляют собой электромагнитное излучение, но с более короткими
длинами волн и соответственно с большей энергией. Все эти виды радиации описала
М.Кюри в своей монографии «Радий и радиоактивность» (опубликована в Париже в
1904, русский перевод – 1905).
Выделение энергии при радиоактивном распаде. Нуклоны в ядре прочно
удерживаются ядерными силами. Для того чтобы удалить нуклон из ядра, надо
совершить большую работу, т. е. сообщить ядру значительную энергию.
Энергия связи
атомного ядра Есв характеризует
интенсивность взаимодействия нуклонов в ядре и равна той максимальной энергии,
которую необходимо затратить, чтобы разделить ядро на отдельные невзаимодействующие
нуклоны без сообщения им кинетической энергии. У каждого ядра своя энергия
связи. Чем больше эта энергия, тем более устойчиво атомное ядро. Точные
измерения масс ядра показывают, что масса покоя ядра mя всегда меньше суммы масс покоя, составляющих
его протонов и нейтронов. Эту разность масс называют дефектом массы:
![]()
Именно эта часть
массы Дт теряется при выделении энергии связи. Применяя закон взаимосвязи массы
и энергии, получим:
![]()
где mн - масса атома
водорода.
|
Реакция деления
тяжелых ядер на ядра элементов средней части таблицы Д.
Менделеева, а также реакции синтеза легких ядер (водород,
гелий) в более тяжелые - энергетически выгодные реакции,
так как они сопровождаются образованием более устойчивых ядер (с большими Еуд) и, следовательно, протекают с выделением
энергии (Е > 0). |
Ядерные реакции расщепления ядер атомов под действием нейтронов. Цепная ядерная
реакция - процесс расщепления тяжелого радиоактивного ядра на более легкие
ядра, сопровождающееся выделением большого количества
энергии - используется в ядерных реакторах для получения тепловой энергии
(управляемая ядерная реакция).
Неуправляемая цепная
ядерная реакция протекает в атомной бомбе. На рис. 1 представлена схема цепной
реакции ядерной реакции под действием нейтронов
Рис. 1. Цепная
ядерная реакция расщепления
5. Молекула как квантово-механическая
система
Молекула - наименьшая структурная
единица элемента, сохраняющая его химические свойства. При химических
превращениях молекулы не сохраняются. Структурная единица материи, которая прихимических превращениях сохраняется – это атом.
Материи на различных структурных
уровнях присущи такие системные свойства как аддитивность
и интегративность.
Аддитивность подразумевает
наличие у системы суммы свойств входящих в нее
компонентов.
Интегративность – означает появление
новых свойств, не сводимых к сумме свойств компонентов, образующих систему.
Структура системы представляет собой упорядоченную связь и взаимодействие между
элементами системы, благодаря которой и возникают новые целостные ее свойства.
Эта особенность системы называется также эмерджентностью.
Ранее существовало мнение, что
структура молекулы возникает благодаря взаимодействию разноименно заряженных
атомов или групп атомов. Однако в дальнейшем было установлено, что при
образовании структур различные атомы не просто взаимодействуют, но известным
образом преобразуют друг друга, так в результате получается целостность или
связанная система, причем взаимодействие и взаимовлияние носят
квантово-механический характер. Таким образом, молекула – это
квантово-механическая система.
В
физически доступном слое Земли всего восемь химических элементов представлены
в значительном количестве. Это кислород 47,0%, кремний 27,5%, алюминий 8,8%, железо
4,6%, кальций 3,6%, натрий 2,6%, калий 2,5% и магний 2,1%.
Практически
все элементы проявляются в земных условиях в составе тех или иных химических
систем — химических соединений. В настоящее время известно более восьми
миллионов соединений. Из них абсолютное большинство (около 96%) — органических.
Проблема
химического соединения традиционно решалась с позиций атомистической
концепции. В начале XIX в. английский химик Дж.
Дальтон обосновал закон постоянства состава, отражающий неизменное соотношение
компонентов данного вещества. Долгое время не допускалось отклонения от этого
закона. Однако уже современник Дальтона французский химик К.Бертолле указывал
на возможность существования соединений переменного состава в форме растворов
и расплавов. Впоследствии были найдены доказательства существования химических
соединений переменного состава.
Позднее структуру молекул стали
связывать с понятием валентности элемента. Дальнейшим шагом в этом направлении
было изучение того, какую роль в образовании молекул из атомов играет энергия,
с которой они связываются друг с другом. В такой химической системе, как
молекула, именно специфический характер взаимодействия атомов определяет новые
целостные свойства молекулы.
Например молекула простого вещества
кислорода О2 образована из двух атомов и имеет все
свойства кислорода как химического вещества, в то время как атомы кислорода
(т.н. атомарный кислород) или озон О3 имеют другие свойства. К молекулам можно
отнести различные квантово-механические системы (ионные, атомные монокристаллы,
полимеры и др. макромолекулы). Таким образом
химическое соединение — это не только сложное вещество, состоящее из одного или
нескольких элементов.
Современное естествознание определяет
химическое соединение следующим образом.
|
Химическое
соединение — это вещество, атомы которого за счет химических связей
объединены в молекулы, комплексы, макромолекулы, монокристаллы или иные
квантово-механические системы. |
Рассматривая химические системы необходимо
знать, что ее свойствазависят не только от состава и
строения элементов, но и от ихвзаимодействия. Поэтому
при изучении химических систем ученым приходитьсяизучать
и их структуру. Например, в такой химической системе, как молекула,именно характер взаимодействия составляющих ее
атомов определяет св-ва молекулы. С другой стороны часто свойства
химической системы зависят от условий получения. Условия могут оказать влияние
на характер и результат химических реакций. Это и термодинамические факторы
(температура, давление) и использование катализаторов.
6. Катализаторы, биокатализаторы
Катализ (от греч. katálysis — разрушение), изменение скорости
химических реакций в присутствии веществ (катализаторов), вступающих в
промежуточное химическое взаимодействие с реагирующими веществами, но восстанавливающих
после каждого цикла промежуточных взаимодействий свой химический состав. Реакции
с участием катализаторов называются каталитическими.
Катализаторы
биологические,
биокатализаторы, вещества, образующиеся в живых клетках и ускоряющие
(положительный катализ) или
замедляющие (отрицательный катализ) химические процессы, протекающие в организмах.
К числу биологгических катализаторов относятся в
первую очередь катализаторы белковой природы, называемые энзимами, или ферментами.
Как всякие катализаторы, Ферменты снижают энергию активации, необходимую для осуществления той или
иной химической реакции, направляя её обходным путём – через промежуточные
реакции, которые требуют значительно меньшей энергии активации.
Так, реакция АБ ® А + Б в присутствии
фермента (Ф) идёт следующим образом:
АБ + Ф ® АБФ и далее АБФ ® БФ + А и БФ
® Б + Ф.
Условия
действия ферментов.
Действие ферментов зависит от ряда факторов, прежде всего от температуры
и реакции среды (pH). Оптимальная
температура, при которой активность ферментов наиболее высока, находится обычно
в пределах 40–50 °С. При более
низких температурах скорость ферментативной реакции, как правило, снижается, а
при температурах, близких к 0 °С, практически реакция
полностью прекращается. При повышении температуры выше оптимальной скорость
ферментативной реакции также снижается и, наконец, полностью прекращается.
Снижение интенсивности действия ферментов при повышении температуры сверх оптимальной объясняется
главным образом начинающимся разрушением (денатурацией) белка.
Важнейшим фактором, от которого
зависит действие ферментов, является активная реакция среды – pH. Отдельные ферменты различаются по оптимальной
для их действия величине pH. Так, например, пепсин, содержащийся в желудочном соке,
наиболее активен в сильнокислой среде (pH 1–2), а
трипсин – фермент, выделяемый поджелудочной железой, имеет оптимум действия в
слабощелочной среде (pH 8–9).
7. Полимеры, мономеры
Особую, очень важную, группу
органических веществ составляют высокомолекулярные
соединения (полимеры). Масса их молекул достигает нескольких десятков тысяч
и даже миллионов. Молекула полимера называется макромолекулой. Молекула полимера построена из многих повторяющихся
частей — более простых органических систем (мономеров). Одной из отличительных
особенностей молекул полимера является
большая молекулярная масса (порядка 106).
Полимерные вещества являются основой
жизни на Земле.
Органические природные полимеры – биополимеры
– обеспечивают процессы жизнедеятельности всех животных и растительных организмов.
Интересно, что из множества возможных вариантов Природа "выбрала"
всего 4 типа полимеров: нуклеиновые
кислоты, белки и полипептиды, полисахариды, полиизопрены.
Благодаря особым, только для них
характерным свойствам, полимеры (синтетические, искусственные и некоторые
природные) широко используются при изготовлении самых разнообразных материалов.